Företaget Intellia Therapeutics ligger i framkant när det gäller att utveckla genomredigerande engångsbehandlingar som baseras på CRISPR/Cas9-teknik. Två behandlingar har kommit långt i klinisk utveckling och kan komma att godkännas inom de närmsta åren. Den ena är utvecklad för Skelleftesjukan och den andra för hereditärt angioödem. Båda är ärftliga och livshotande sjukdomar.
Intellia Therapeutics grundades av bland andra Jennifer Doudna, en av de två forskare som mottog Nobelpris för att ha utvecklat tekniken CRISPR/Cas9. Företaget är ett av många, men ligger i framkant av de som arbetar med att ta fram genomredigerande engångsbehandlingar mot ärftliga sjukdomar.
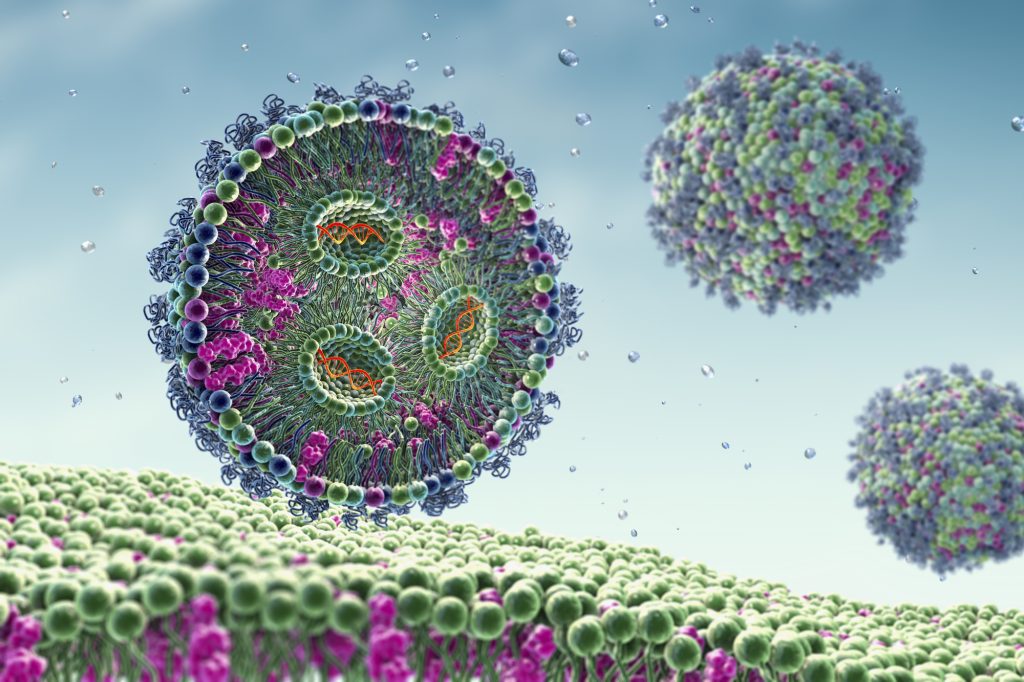
CRISPR/Cas9 transporteras till celler i små fettbubblor
Gemensamt för de två behandlingarna är att CRISPR/Cas9 kapslas in i mikroskopiska fettbubblor, lipida nanopartiklar, och injiceras direkt till blodet. Företaget blev år 2021 först med att ge patienter CRISPR/Cas9 direkt i blodet. Det vanligaste förfarandet är annars att isolera celler som redigeras i laboratoriet innan de återförs som behandling.
Nanopartiklarna är försedda med ett ytprotein som binder till en receptor på ytan av leverceller vilket leder till att partikeln tas upp endast av den typen av celler. På så sätt finns en adresslapp fäst vid nanopartikeln. Inne i cellerna tar sig CRISPR/Cas9 vidare in i cellkärnan och stänger av den gen som orsakar sjukdom.
Anledningen till att behandlingarna riktas mot lever-celler är att de två sjukdomar som behandlingarna utvecklats för i hög utsträckning utgår ifrån att leverceller tillverkar för mycket av ett protein, eller konstruerar ett felaktigt protein.
Skelleftesjukan – mindre dödlig idag tack vara genteknik
Den första CRISPR-behandlingen, som prövades redan 2021, utvecklades för patienter med ärftlig transtyretinamyloidos. Sjukdomen kallas även ”Skelleftesjukan” eftersom den är relativt vanlig i trakterna runt Skellefteå.
Sjukdomen orsakas av mutationer i genen TTR som leder till att proteinet transtyretin tillverkas på ett felaktigt sätt, klumpar ihop sig, ansamlas och skadar vävnader och organ som till exempel hjärta och njurar.
Flera godkända läkemedel
Länge var levertransplantation den vanligaste bromsande behandlingen. Nu finns två godkända läkemedel som baseras på oligonukleotider (små korta sekvenser av DNA eller RNA) där strategin är att hämma tillverkningen av transtyretin. Oligonukleotiderna ger god effekt men är kostsamma och måste ges regelbundet eftersom de inte integreras i patientens genom utan bryts ner i kroppen.
Reducerar halten transtyretin i blodet
Den engångsbehandling som Intellia Therapeutics utvecklat innebär att TTR– genen stängs av med CRISPR/Cas9 så att tillverkningen av transtyretin i leverceller avbryts.
I studien från 2021 visade resultaten att behandlingsprincipen fungerade och att koncentrationen transtyretin i patienternas blod minskade signifikant. Studien indikerade också att behandlingen inte ger oacceptabla biverkningar.
Ger positiv behandlingseffekt
Under 2024 publicerades resultat från en större klinisk prövning med 36 patienter som hade transyretinamyloidos med förstorad hjärtmuskel som en komplikation. Eftersom sjukdomen är progressiv och skador redan uppstått i kroppen så förväntades inga stora kliniska förbättringar.
Forskarna undersökte därför om behandlingen i stället stabiliserat sjukdomsförloppet. Hos 92 procent av patienterna kunde forskarna se att sjukdomen stabiliserats eller till och med förbättrats ett år efter behandlingen.
Heriditärt angioödem ger smärtsamma skov av inflammation
Intellia Therapeutics har använt samma behandlingsprincip för en sjukdom som heter hereditärt angioödem. Sjukdomen orsakas av en överproduktion av proteinet bradykinin som leder till att små blodkärl läcker vätska till kringliggande vävnader.
Patienter med sjukdomen drabbas av smärtsamma och plötsliga inflammatoriska skov som gör att organ och vävnader svullnar upp. Hur ofta skoven infaller varierar med ett genomsnitt på ungefär två skov i månaden som pågår under några dagar. Idag finns ingen godkänd behandling för sjukdomen. Patienter ges olika läkemedel för att lindra och hämma skoven av inflammation.
Färre sjukdomsskov efter behandling
Den genomredigerande behandlingen mot hereditärt angioödem stänger av genen kallikrein B1 (KLKB1) som annars driver överproduktionen av bradykinin. I en studie som publicerades 2024 fick 27 patienter med sjukdomen motta behandlingen.
Före och efter behandlingstillfället mättes det genomsnittliga antalet inflammatoriska skov per månad. Resultaten visade att skoven reducerades med 75–80 procent under de första sexton veckorna. Efter 16 veckor hade varannan patient ännu inte drabbats av sjukdomsskov.
Behandlingar som kan förändra liv – men har samhället råd?
Behandlingarna som beskrivs ovan är utvecklade för två patientgrupper med en tung sjukdomsbörda. Om behandlingarna fortsatt visar säkerhet och positiv behandlingseffekt även i större studier så kan de bli livsförändrande. I synnerhet om de sätts in tidigt i sjukdomarnas förlopp innan vävnader och organ hunnit skadats.
Ett orosmoln är de höga kostnader som hittills kommer med genterapier. Under 2024 godkändes den första CRISPR-baserade behandlingen inom EU. Behandlingen som heter Casgevy verkar i stort sett kunna bota två ärftliga hemoglobinsjukdomar. Prislappen per patient och behandling beräknas hamna på över 20 miljoner SEK.
Ur ett hälsoekonomiskt perspektiv är genterapier generellt svårbedömda bland annat eftersom de är så dyra och det finns en osäkerhet i hur länge effekten av behandlingen varar. Varje lands hälsoekonomiska utredning ligger till grund för om en ny behandling överhuvudtaget kommer att bli tillgänglig för patienter.
/Mia Olsson
Källor:
- Fontana, M. et al. CRISPR-Cas9 Gene Editing with Nexiguran Ziclumeran
for ATTR Cardiomyopathy. N. Engl. J. Med. 391, 2231–2241 (2024). - Cohn, D.M. et al. CRISPR-Based Therapy for Hereditary Angioedema. N. Engl. J. Med. 392, 458-467 (2024).
- Hilary, J. et al. CRISPR-Cas9 In Vivo Gene Editing of KLKB1 for Hereditary Angioedema. N. Engl. J. Med. 390, 432-441 (2024).
- Gillmore J.D. et al. CRISPR-Cas9 In Vivo Gene Editing for Transthyretin Amyloidosis. N. Engl. J. Med. 385, 493-502 (2021).
