Geners aktivitet varierar
Trots att alla celler i en individ innehåller samma DNA så kan de se väldigt olika ut, ha olika funktioner och bygga upp vitt skilda vävnader och organ. Det beror på att alla gener inte är aktiva vid samma tidpunkt och lika mycket i alla celler. Det kallas variationer i genuttryck och förklarar mycket av livets komplexitet och mångfald.
Genuttryck kan vara högt eller lågt
När en gen är ”påslagen” och uttrycks läses den av (transkription) och informationen används för att tillverka protein (translation). En gens uttryck kan vara högt eller lågt och avspeglar hur många mRNA-kopior av genen som bildas vid transkriptionen.
I regel finns ett positivt samband mellan antalet mRNA-molekyler och hur mycket protein som tillverkas. Ett högt genuttryck brukar generera mycket av det protein som genen kodar för, och vice versa.
Faktorer som styr genuttryck är till exempel de kemiska föreningar som ger epigenetiska förändringar och en grupp proteiner som heter transkriptionsfaktorer. Det finns också RNA-molekyler som kan justera genuttryck efter att mRNA bildats från genen.
Transkriptionsfaktorer
Transkriptionsfaktorer styr uttrycket av en gen i samband med transkriptionen, när informationen i genen läses av och en kopia i form av ett mRNA bildas.
Enzymet RNA-polymeras II är själva motorn under transkriptionen, men enzymet styrs av transkriptionsfaktorerna. Förenklat så kan de antingen hjälpa eller hindra enzymet att göra sitt jobb.
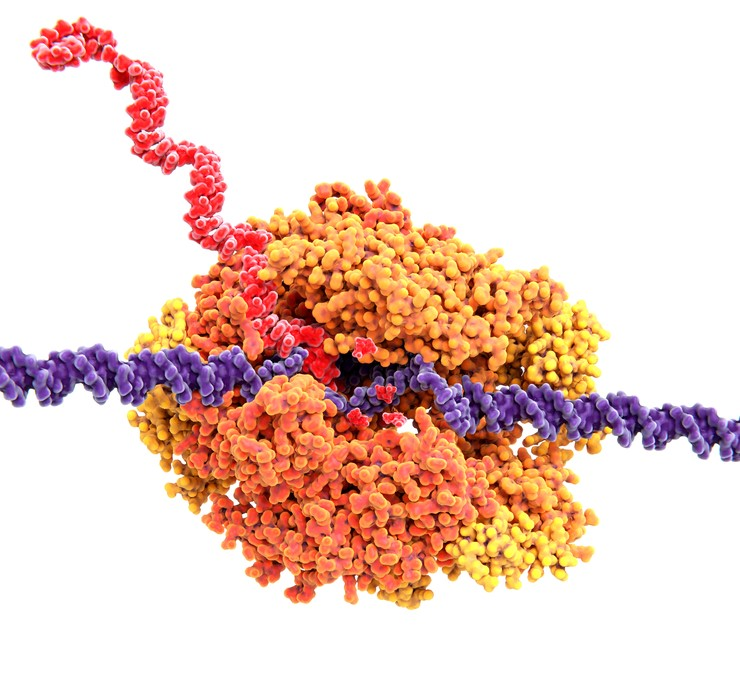
Generella transkriptionsfaktorer styr många gener
För att en gen ska transkriberas krävs det att den först aktiveras. Det gör den med hjälp av en grupp generella transkriptionsfaktorer som är gemensamma för alla gener.
Den här gruppen transkriptionsfaktorer ser till att DNA-strängarna separeras så att genen blir tillgänglig att transkriberas. De markerar också för RNA-polymeraset att det ska binda till genens promotor och starta transkriptionen.
Specifika transkriptionsfaktorer finjusterar genuttryck
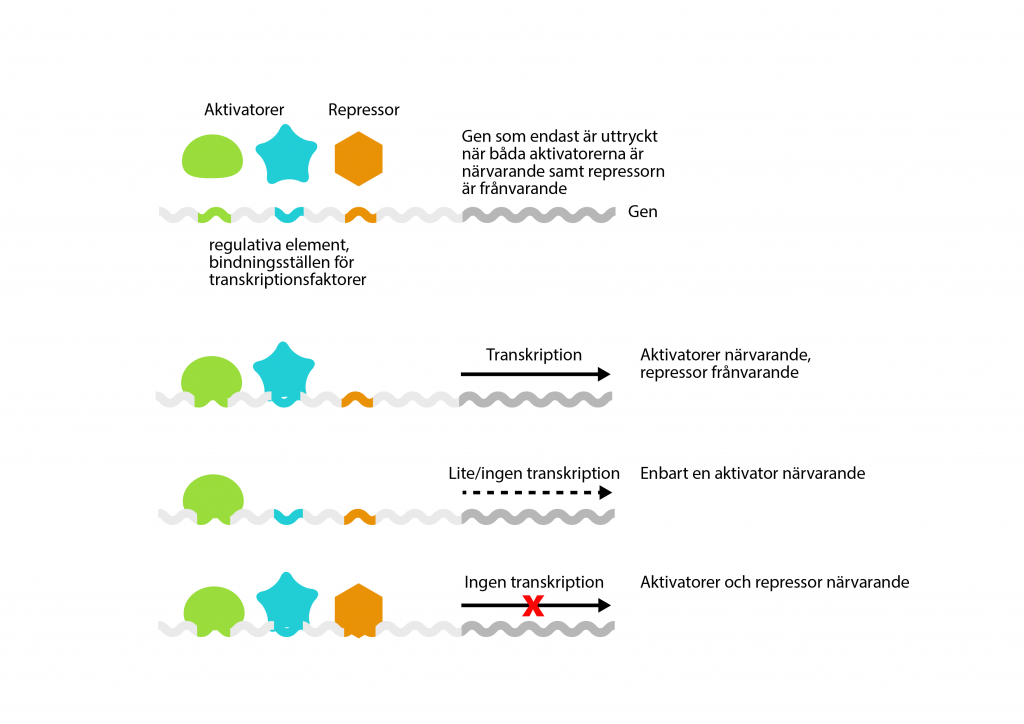
Det finns även specifika transkriptionsfaktorer som var och en styr uttrycket av en eller ett fåtal gener. De fäster vanligtvis längre ifrån genen, i icke-kodande DNA-sekvenser som kallas regulatoriska element (eller reglerelement).
En specifik transkriptionsfaktor kan vara en aktivator som främjar transkriptionen genom att hjälpa RNA-polymeraset att binda till promotorn. Den kan också vara en repressor som hindrar transkriptionen och sitter i vägen för RNA-polymeraset.
Specifika transkriptionsfaktorer finjusterar genuttrycket och samverkar ofta i stora nätverk där ”summan” av aktivatorer och repressorer ger det totala genuttrycket.
Genuttrycket anpassas till miljön
Vilka gener som uttrycks beror på signaler som cellen ta emot. Signalerna kan uppstå inne i cellen eller komma från närliggande celler. Signaler kan också genereras till följd av förändringar i den miljö som omger cellen och organismen. På så sätt kan cellen i realtid anpassa sina uppgifter och vilka proteiner som tillverkas till en rådande situation.
De signaler som cellen tar emot omvandlas till att olika transkriptionsfaktorer aktiveras. Det i sin tur leder till att uttrycket av en eller flera gener förändras. Signalerna blir som en beställning av vilka proteiner som behövs, och transkriptionsfaktorerna verkställer beställningen.
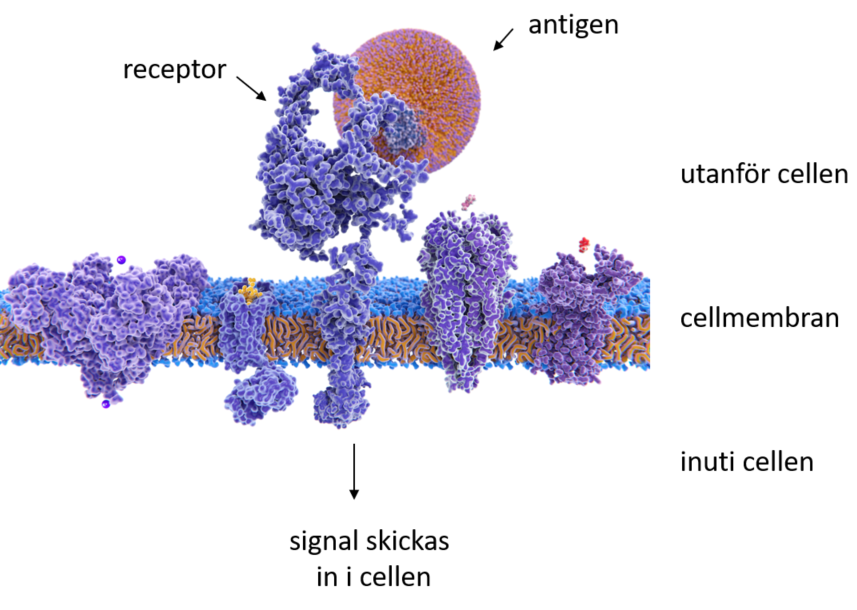
Ett exempel på en signal som cellen kan motta från sin omgivning är när receptorer på ytan av en immuncell upptäcker ett antigen som inte hör hemma i kroppen. Då skickas en signal in i cellen som fortplantas till en lång kedja av signaler. I slutet av signalkedjan aktiveras transkriptionsfaktorer, som aktiverar ett flertal gener med funktioner i immunförsvaret. När generna uttrycks tillverkas proteiner som hjälper till att bekämpa hotet.
Epigenetiska förändringar
Epi är grekiska och betyder ”på” eller ”över”, epigenetik är alltså något som är ”på genetiken”. Det handlar om modifieringar i genomet som inte ändrar DNA-sekvensen.
Rent konkret betyder en epigenetisk förändring att genuttrycket påverkas av att kemiska föreningar som har fäst antingen direkt till DNA-sekvensen eller till de histonproteiner som DNA ligger snurrat runt. De kemiska föreningarna bildar ett unikt epigenetiskt mönster hos varje individ. När DNA kopieras inför en celldelning följer mönstret med.
Forskare vet mest om de tre epigenetiska förändringarna metylering, acetylering och fosforylering. Av dessa tre verkar DNA-metylering vara den vanligast förekommande.
DNA-metylering tystar gener
Vid DNA-metylering fäster en eller flera metylgrupper (-CH3) vid DNA-sekvensen. Hos ryggradsdjur är det vanligast att metylgrupper fäster till kvävebasen cytosin (C) när den sitter bredvid guanin (G). Just den kombinationen är vanlig i promotorn (startsekvensen) av en gen.
När metylgrupper fäster i en gens promotor så sitter de i vägen för RNA-polymeras II och transkriptionsfaktorer så att genen inte aktiveras. En gen vars promotor är metylerad uttrycks i regel därför lite, eller inte alls.
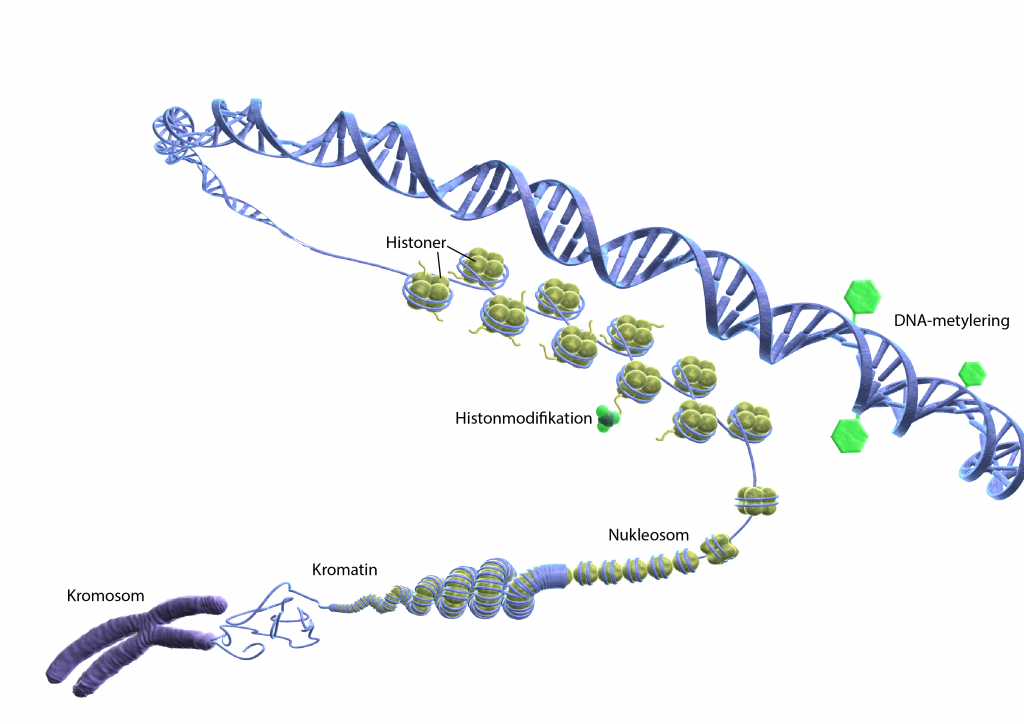
Histonmodifiering öppnar och stänger DNA-spiralen
En annan typ av epigenetisk förändring kallas histonmodifiering och går enklast att förstå om man tittar närmare på hur DNA packas ihop i kromosomer. Förutom DNA består kromosomerna främst av en sorts proteiner som heter histoner. DNA-strängen ligger virat runt histonerna. Ungefär 200 baspar DNA viras runt fyra histoner och bildar en enhet som heter nukleosom. Dessa snurras ihop till en tredimensionell struktur som kallas kromatin.
Till histoner fäster metyl-, acetyl-och fosforgrupper. De två första hindrar respektive främjar genuttryck. Hur histonfosforylering påverkar genuttrycket är mindre känt.
Histonmetylering
Vid histonmodifiering ändras strukturen av kromatinet och hur hårt packat det är. Om histonerna till exempel metyleras så packas kromatinet hårt. Det gör att en gen som finns i det området på kromosomen är otillgänglig för att aktiveras av RNA-polymeras II och transkriptionsfaktorer. En gen i ett histon-metylerat område har därför ett lågt uttryck, eller inget alls. Om metylgrupperna släpper så binds DNA lite lösare kring histonerna och genuttrycket ökar
Histonacetylering
Om histoner istället acetyleras fäster acetylgrupper till proteinet vilket ger ett löst packat kromatin. En gen som finns i ett område av DNA-molekylen där histoner har acetylerats, har därför ofta ett högt uttryck eftersom genen är tillgänglig för RNA-polymeras II och de transkriptionsfaktorer som behövs för att aktivera genen. Om acetylgruppen släpper så binds DNA tätare kring histonerna igen och genuttrycket minskar.
Små RNA-molekyler
Oftast finns ett positivt samband mellan antalet mRNA-molekyler som bildas från en gen och mängd protein som tillverkas – men inte alltid.
Det finns små RNA-molekyler som interagerar med mRNA och hindrar det från att nå proteintillverkningen. Det är ett sätt för celler att finjustera uttrycket av gener även efter transkriptionen. Ibland talar man om att gener på det här sättet tystas.
Två typer av små RNA-molekyler som kan styra geners uttryck är mikroRNA (miRNA) och små interfererande RNA (siRNA). Båda typerna är viktiga för organismers komplexitet eftersom de bidrar mycket till att celler kan ha olika utseende och funktion.
En gemensam benämning för alla siRNA och miRNA är RNA interferens (RNAi).
mikroRNA blockerar mRNA
Ett miRNA basparar med ett mRNA som bildats när en gen transkriberas och hindrar det från att användas som mall vid proteintillverkningen. Resultatet blir att mindre protein bildas från en viss gen.
Vi människor har tusentals gener som kodar för olika miRNA vars funktion är att finjustera uttrycket av andra gener. Slutprodukten när en miRNA-gen uttrycks är alltså inte ett protein, utan en 21-22 nukleotider kort miRNA-molekyl.
Yttrycket av miRNA-kodande gener varierar också i cellen. Ju högre uttryck en miRNA-kodande gen har, ju mer kan det dämpa uttrycket av den gen som miRNA-molekylen justerar. Den här balansgången ger celler möjlighet att med hög precision justera exakt vilka proteiner som ska bildas, när de ska bildas och i vilken mängd.
Upptäckten av miRNA tilldelades år 2024 ett Nobelpris.
Läs mer på Nobelpriset i fysiologi eller medicin 2024 (nobelprize.org).
siRNA bryter ner mRNA
Ett siRNA kan klyva ett mRNA som bildats när en gen transkriberas. Cellen uppfattar ett trasigt mRNA som något främmande eller dysfunktionellt och bryter ner det. På så sätt hindras mRNA från att användas som mall vid proteintillverkningen. Resultatet blir att mindre protein bildas från en viss gen.
siRNA är 20-24 nukleotider korta snuttar av RNA som bildas med hjälp av ett enzym som processar dubbelsträngat RNA.
Upptäckten av siRNA tilldelades år 2006 ett Nobelpriset.
Läs mer på Nobelpriset i fysiologi eller medicin 2006 (PDF) (nobelprize.org).
Medicinska behandlingar med siRNA
En ärftlig sjukdom kan orsakas av en mutation i en gen som leder till att det tillverkas för mycket av ett visst protein, eller att proteinet tillverkas felaktigt. En behandlingsstrategi kan då vara att stänga av en sådan gen med siRNA.
Ett exempel är två behandlingar som utvecklats för sjukdomen ärftlig transtyretinamyloidos som även kallas Skelleftesjukan. Sjukdomen orsakas av en mutation i genen TTR gör att proteinet transtyretin byggs upp felaktigt, klumpar ihop sig och lagras i kroppen på ett sätt som skadar vävnader och organ. Med ett siRNA som är designat att binda till det mRNA som TTR-genen ger upphov till, stängs tillverkningen av transtyretin av. Eftersom RNA som molekyl bryts ned snabbt ges behandlingarna regelbundet.
Uppdaterat 2025-09-10
