Vad är en gendrivare?
En gendrivare är både en naturlig process och en teknik. Gendrivaren är en DNA-sekvens som sprids snabbare i en population än förväntat, även om den inte ger en selektiv fördel.
DNA som bryter mot ärftlighetslag
Genetikens fader George Mendel fastställde redan på 1800-talet tre lagar om ärftlighet efter att han systematiskt studerat hur egenskaper som t.ex. färg och form nedärvs hos ärtor. Den första lagen fastställer att ärftliga egenskaper bestäms av ärftliga faktorer som uppträder parvis. Idag kallar vi faktorerna för alleler eller genvarianter. En individ ärver en genvariant från var och en av sina föräldrar.
Över tid sprids de genvarianter och blir vanliga i en population som ökar individens chanser att överleva och fortplanta sig. En genvariant som inte är gynnsam försvinner i regel ur en population på sikt – om populationen är tillräckligt stor.
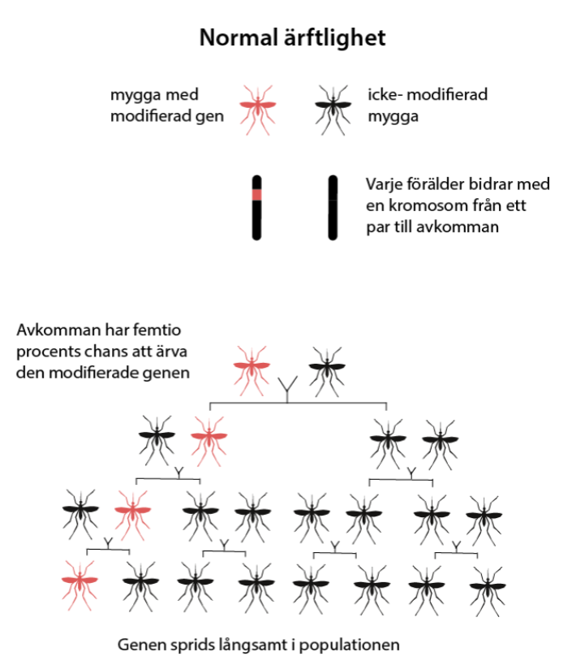
Gendrivare är DNA-sekvenser som bryter mot Mendels första lag. De kallas ibland själviskt DNA eller själviska gener och sprider sig snabbt i en population även om de inte ger individen en fördel. Nedan följer några exempel på naturliga processer som gör att vissa DNA-sekvenser förekommer oftare än förväntat.
Transposoner
En typ av själviskt DNA kallas för transposoner och är DNA-sekvenser med förmåga att flytta sig i genomet. En del transponsoner kopierar sig själv så att den nya kopian infogas i en annan del av genomet (copy-and-paste), medan andra klipps ut och infogas (cut-and-paste). Den här egenskapen hos en transposon gör att den förekommer oftare än vad som är förväntat enligt Mendels första ärftlighetslag.
En transposon anses vara en evolutionär rest av infektioner av retrovirus som av någon anledning förlorat förmågan att ta sig vidare till nya celler. När ett retrovirus infekterar en värdcell fogar viruset in sitt eget genetiska material i cellens genom. Just retrovirus har RNA som genetiskt material men i innan det fogas in i värdcellens genom omvandlas det till DNA. Värdcellen tillverkar då de proteiner som viruset behöver för att spridas vidare till fler celler.
Målsökande enzymer och HEGs
Det finns en grupp enzymer som på engelska kallas för homing endonucleases som kan översättas med målsökande endonukleaser på svenska. Enzymerna känner igen en specifik DNA-sekvens, en målsekvens, som de klipper itu. De gener som kodar för enzymerna kallas för HEGs (homing endonuclease genes). Varje HEG är lokaliserat inom ”sitt enzyms” målsekvens. HEGs förekommer oftare än förväntat i en population eftersom de kan omvandla en heterozygot till en homozygot.
Förenklat går det till så här: Om en HEG finns på den ena DNA-strängen i ett kromosompar (en heterozygot) så klipper enzymet bara av den andra DNA-strängen. I cellen finns system som lagar skador på DNA och vid lagningen används den intakta DNA-strängen – den som har en HEG – som mall. Resultatet efter lagningen blir ett kromosompar där båda kromosomerna har en HEG (en homozygot).
När kromosomparen delas upp under meiosen (bildningen av könsceller) kommer alla könsceller ha en kromosom med DNA-sekvensen för HEG, istället för femtio procent som skulle vara det förväntade utfallet givet att individen var heterozygot från början.
Gendrivare som teknik
Forskare har inspirerats av det själviska DNA:t och redan i slutet av 1960-talet fanns tanken på att använda processen för att snabbt driva upp frekvensen av en egenskap i en population. Det användningsområde som fått mest fokus är att minska populationer med malariamyggor med en gendrivare genom att sprida en egenskap som inte är gynnsam för individen, till exempel sterilitet hos hanar.
CRISPR/Cas förvandlar heterozygot till homozygot
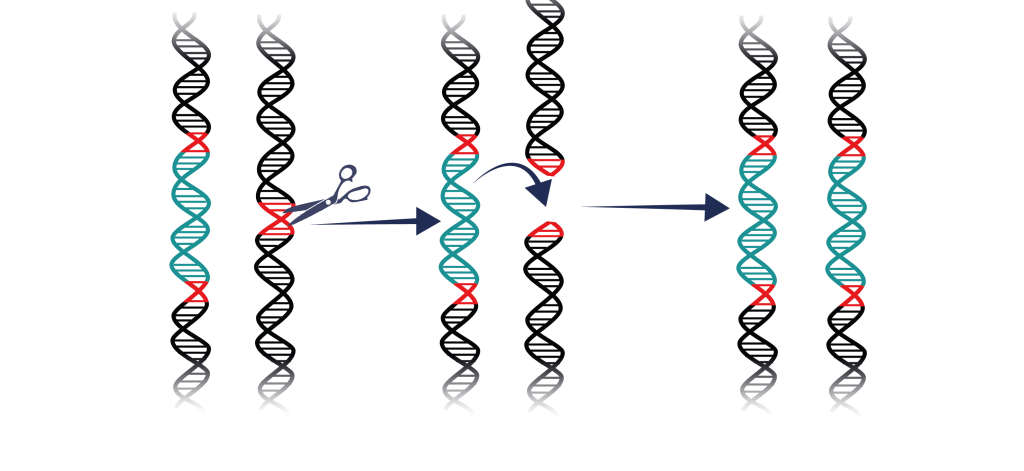
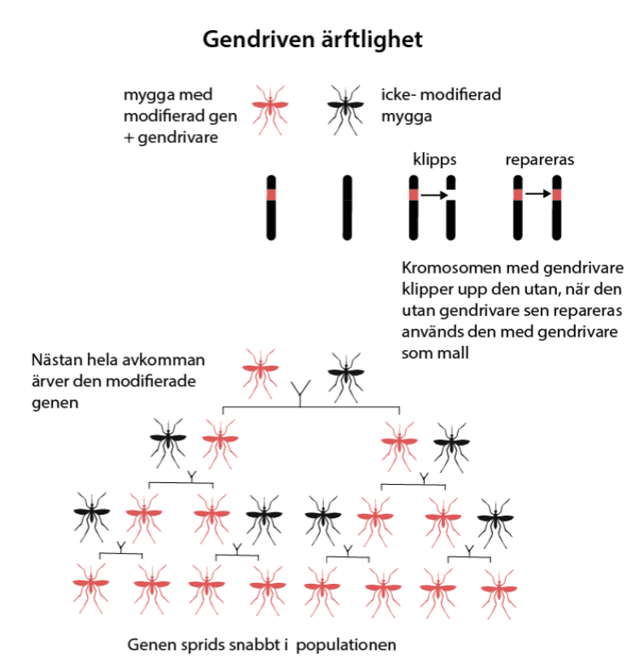
När gensaxen CRISPR/Cas utvecklades tog forskningsområdet om gendrivare fart. Det visade sig nämligen att CRISPR-systemet är som klippt och skuret för att få en gen – och därmed egenskap- att snabbt sprida sig i en population. CRISPR/Cas fungerar i det här sammanhanget som gendrivare som kopplas till den gen som ska spridas. Det liknar den naturliga processen med HEGs som beskrivs i avsnittet ovan.
I korthet så gör gendrivaren att en heterozygot omvandlas till en homozygot. Om den gen eller genvariant som är kopplad till gendrivaren bara finns på den ena kromosomen i ett kromosompar så ser gendrivaren till att den finns på båda. Det har därför ingen betydelse vilken spermie eller vilket pollen som befruktar vilket ägg. Avkomman kommer ändå att ha den egenskap som gendrivaren sprider.
In-zoomning på hur en gendrivare fungerar
Ut-zoomning på hur en gendrivare fungerar
Gendrivare i insekter
Gendrivare fungerar bara på organismer som förökar sig sexuellt och för att spridningen i en population ska vara effektiv måste generationstiden vara kort. Insekter som bananflugor och myggor har kort generationstid, ett ägg utvecklas till en fullvuxen fluga eller mygga på några få veckor. Många sjukdomar sprids av myggor, till exempel malaria, denguefeber, zika och chikungunya och hittills har de flesta försök med gendrivare testats på myggor.

Första gången det visades att gendrivare fungerar i praktiken var när forskare under 2015 fick en genvariant att snabbt sprida sig i en population av bananflugor. Det verktyg som användes som gendrivare var CRISPR/Cas9 och den genvariant som spreds ledde till att alla flugor i populationen fick gula ögon. Samma år visade forskare att det även fungerar i två arter av malariamyggor. Med CRISPR/Cas9 har bland annat sterilitet bland honor av malariamyggor spridits. Det ledde till att hela populationen kollapsade.
Andra möjliga användningsområden
Ett annat användningsområde som testats är att få en patogen svamp att inte orsaka sjukdom eller producera gifter som är skadliga för människan. En gendrivare kopplades till en gen som via mutationer stängde av de gener i svampens arvsmassa som orsakar sjukdom och bildar svampgift. Svampen som testades heter på latin Fusarium graminearum och orsakar stora skördeförluster i bland annat vete.

I det här fallet användes inte CRISPR/Cas9 som gendrivare utan en gen som isolerats från en annan svamp. Det diskuteras också om gendrivare skulle kunna användas för att utrota invasiva arter och att göra skadegörare som blivit resistenta mot ett bekämpningsmedel känsliga igen.
Samtliga försök som hittills genomförts har skett på laboratorium. Inom EU har EFSA fått i uppdrag att identifiera potentiella risker med gendrivare när det gäller påverkan på människor och djurs hälsa och på miljön. De ska också undersöka om vägledningsdokumenten för riskbedömning av GMO även kan användas för gendrivare eller om de behöver utvecklas.
Uppdaterad: 2024-05-23

