Genetiskt modifierade möss har använts inom medicinsk forskning sen 80-talet. Ofta kallas genetiskt modifierade möss för transgena, vilket åsyftar att de har en eller flera nya gener som kommer från en annan art – till exempel människa. Den första genetiskt modifierade musen föddes 1974, men det dröjde till början av 80-talet innan forskare lyckades ta fram möss som överförde den genetiska modifieringen till sin avkomma. Detta var startskottet för alla de avelslinjer av möss som används idag, där alla möss i samma linje bär på samma genetiska modifiering.
Används som sjukdomsmodeller
Framför allt så används genetiskt modifierade möss som sjukdomsmodeller för att studera sjukdomar som förekommer hos människor. Till exempel kan en mus modifieras med en muterad mänsklig gen som orsakar en genetisk sjukdom. Den muterade genen kan då studeras i ett biologiskt system, in vivo. Olika musmodeller är modifierade och framavlade för att studera olika sjukdomar, till exempel diabetes och olika typer av cancer. Genetiskt modifierade möss används också för att förstå vilken funktion alla gener och proteiner har. Om en viss gen i en mus ”slås ut” (så kallade knock-out möss) kan forskare studera vilka funktioner i kroppen som påverkas.
Varför möss?
Möss har använts länge inom medicinsk forskning, det finns därför mycket kunskap om hur de fungerar och hur de beter sig. Forskare känner också till vilka värden som är ”normala” hos möss, vilket underlättar för att dra slutsatser från försöken. Möss har också liknande organ som oss människor och nästan samma uppsättning gener. Andra fördelar är att möss är ganska enkla att sköta om, de förökar sig snabbt och är inte så känsliga för infektioner. När läkemedel testas behövs också mycket mindre volymer än om de skulle testas på ett större däggdjur.
Knock-in, knock-out och transgena möss
Den vanligaste modifieringen hos möss är att en gen tystas eller ”slås ut”. Även i Sverige används det engelska uttrycket knock-out. På så sätt kan enskilda geners funktion studeras – vad händer i kroppen när inte en viss gen fungerar? En del gener behövs för att ett liv överhuvudtaget ska utvecklas – och en knock-out är då inte möjlig. Ett alternativ är då att tysta genen i enskilda organ eller vävnader. Det kallas för en conditional knock-out. Utan dessa metoder skulle vi inte veta så mycket om geners funktion som vi gör idag.
Det finns också knock-in, där en ny gen sätts in i genomet, eller överuttrycks så att det protein genen kodar för tillverkas i större mängd än normalt. En mus som fått en ny gen från en annan art är en transgen mus. En transgen är en DNA-sekvens som används för att modifiera en organism. Det kan vara en gen som tillverkats med nukleotider i ett laboratorium. En transgen måste bestå av en promotor som startar transkriptionen (avläsningen) av genen och exoner som innehåller de protein-kodande sekvenserna. I slutet av den sista exonen måste det också finnas en stopp-sekvens som gör att transkriptionen avslutas.
Så här modifieras möss genetiskt:
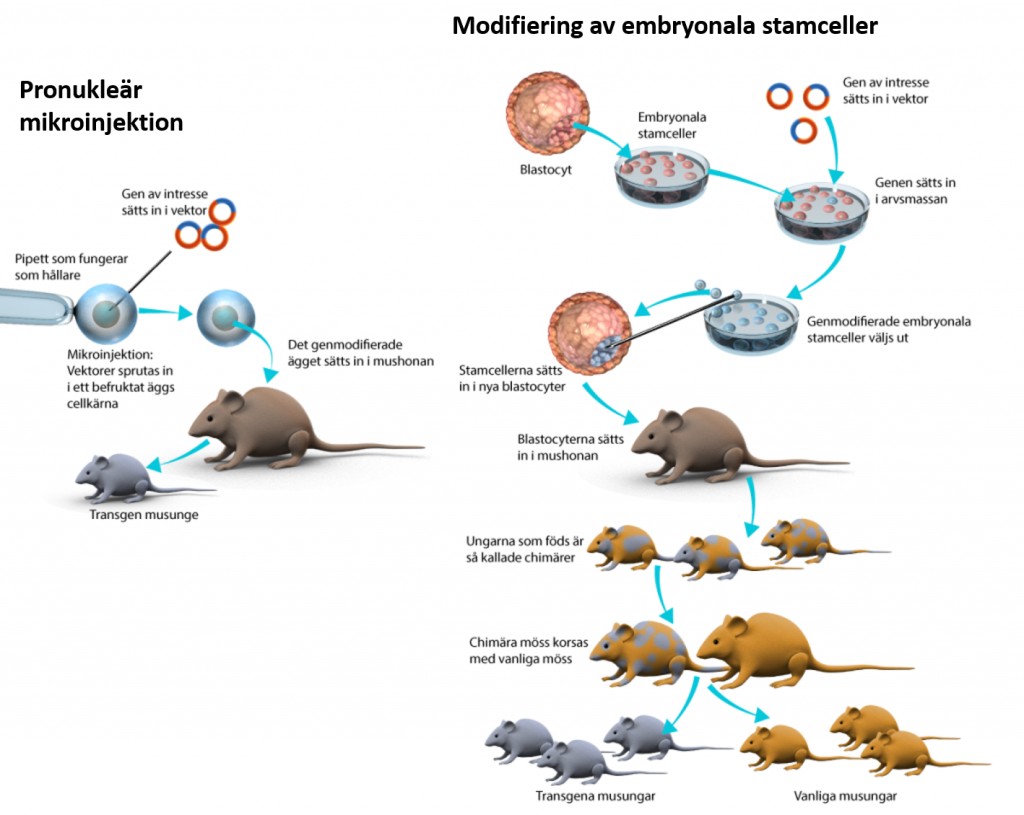
Två huvudsakliga metoder används när en genetiskt modifierad mus framställs. Den metod som funnits allra längst och fortfarande används är pronukleär mikroinjektion. Metoden går ut på att nytt DNA, till exempel en gen, injiceras in i cellkärnan på en nyligen befruktad äggcell, en så kallad zygot. Det görs in vitro. Det befruktade ägget sätts sedan in i livmodern hos en mushona där det utvecklas till ett embryo och vidare till en musunge. Metoden är svår och det är lätt att cellkärnan går sönder. Ofta krävs många äggceller för att få till en transgen mus.
Det andra sättet är att modifiera embryonala stamceller in vitro, och föra in dessa i ett några dagar gammalt musembryo. I den fasen kallas embryot för en blastocyst och består av ett vätskefyllt hålrum dit de modifierade stamcellerna injiceras. Eftersom de är stamceller kan de utvecklas till vilka specialiserade celler som helst. När embryot växer och utvecklas till en musunge kommer den att bestå av både modifierade och icke-modifierade celler. Det kallas för chimära möss. Några av de modifierade cellerna kan vidareutvecklas till könsceller och modifieringen förs då vidare till nästa generation. Via korsningsscheman kan man få fram möss efter några generationer som bara består av genetiskt modifierade celler.
Tre exempel på sjukdomsmodeller med genmodifierade möss
Det finns hundratals olika avelslinjer med genetiskt modifierade möss som alla bär på samma genetiska förändring. Forskare delar ofta med sig av möss de utvecklat i ett speciellt syfte, det går också att köpa mössen från företag. All användning av försöksdjur inklusive genetiskt modifierade möss kräver ett etiskt tillstånd som utfärdas av speciella kommittéer. Det finns sex regionala djurförsöksetiska nämnder i Sverige där varje nämnd består av 14 ledamöter där ordföranden och vice ordföranden är jurister. Resten av kommittén består av forskare, försöksdjurspersonal och lekmän som bland annat representeras av personer från djurskyddsorganisationer.
Möss med mutationer som ger Alzheimers
Personer med Alzheimers sjukdom har förhöjda nivåer i hjärnan av ett protein som heter amyloid-beta. Dessa proteiner klumpar ihop sig vid nervtrådarna och bildar ett så kallat plack som gör att kontakten mellan nervceller blockeras. De symtom som är typiska för sjukdomen, inklusive försämrat minne, sämre tidsuppfattning, svårigheter att prata och känna igen det man ser, tros komma från att placket hindrar impulser från att nå hjärnan.
Hos ungefär tio procent av personer som utvecklar Alzheimers tidigt i livet finns mutationer i genen APP som kodar för amyloid-beta. En musmodell som heter Tg2576 är genetiskt modifierad att efterlikna en patient med Alzheimers. Modifikationen är att de också har en mutation i APP som gör att de likt Alzheimer-patienter tillverkar förhöjda nivåer av amyloid-beta. Alzheimers beror även på andra orsaker än mutationer i APP, men bildningen av plack är en viktig aspekt av sjukdomen som kan studeras med hjälp av Tg2576.
Studera virusutbrott med humaniserade möss
Möss och människor delar stora delar av uppsättningen av gener. Det betyder inte att DNA-sekvenserna eller proteinerna som generna kodar för är exakt samma. När ett virus infekterar och tar sig in i en cell så görs det via någon av cellens alla yt-receptorer. Viruset är ofta specifikt och behöver en viss receptor, så som den ser ut hos en viss art. Ett virus som infekterar människor brukar därför inte kunna infektera möss.
Infektionssjukdomar kan ändå studeras med möss som modell om den mänskliga gen som kodar för ”rätt” yt-receptor förs in i musens genom. Efter utbrottet 2013 av SARS-Cov (som orsakar SARS) så fastställdes det att viruset infekterade celler via en yt-receptor som heter ACE2. Flera musmodeller utvecklades som hade den mänskliga genen av ACE2 för att studera just det viruset och hur det sprider sig. En transgen mus som fått en mänsklig gen kallas för humaniserad. Eftersom SARS-Cov och SARS-Cov-2 (som orsakar covid-19) båda är coronavirus så är det möjligt att de modeller som redan utvecklats kan komma till nytta för att studera covid-19.
Möss utan NOD2 används för att studera inflammation
NOD2 är ett protein som har en viktig roll för immunförsvaret. Om en bakterie som inte hör hemma i kroppen ändå tagit sig in, känner NOD2 av det och aktiverar immunförsvaret så att hotet kan elimineras. NOD2 har också en dämpande effekt på immunförsvaret, en funktion som är nog så viktig för att inte okontrollerad och kronisk inflammation ska uppstå. Framför allt verkar NOD2 ha en stabiliserande effekt på balansen i magen mellan vår bakterieflora och bakterier som orsakar sjukdomar.
Det finns särskilda avelslinjer med genetiskt modifierade möss som helt saknar NOD2, har lägre nivåer av NOD2, eller bara saknar NOD2 i något enskilt organ. Med dessa modeller har forskare ökat vår kunskap om hur mutationer i NOD2 kan leda till inflammatoriska sjukdomar. Till exempel forskning visat att utan NOD2 ökar risken att utveckla inflammation i tarmen och kolekteralcancer.
Andra arter som genmodifieras och används inom forskning

Andra arter än möss genetiskt modifieras och används inom forskning, till exempel råttor, bananflugor och zebrafiskar. Bananflugor och zebrafiskar är billigare att använda och zebrafiskar har dessutom fördelen att de är genomskinliga, vilket gör det möjligt att enkelt följa vad som händer inne i fisken. Det kan vara praktiskt om man till exempel vill testa ett nytt läkemedel för en sjukdom som drabbar hjärnan. Den aktiva molekylen i läkemedlet kan färgas och följas i zebrafisken för att se om den tas upp av hjärnan eller någon annan vävnad. Bananflugor har använts länge och mycket inom genetisk forskning och har bidragit till mycket av den grundläggande genetik vi känner till idag.

