En bakterie som genmodifierar växter
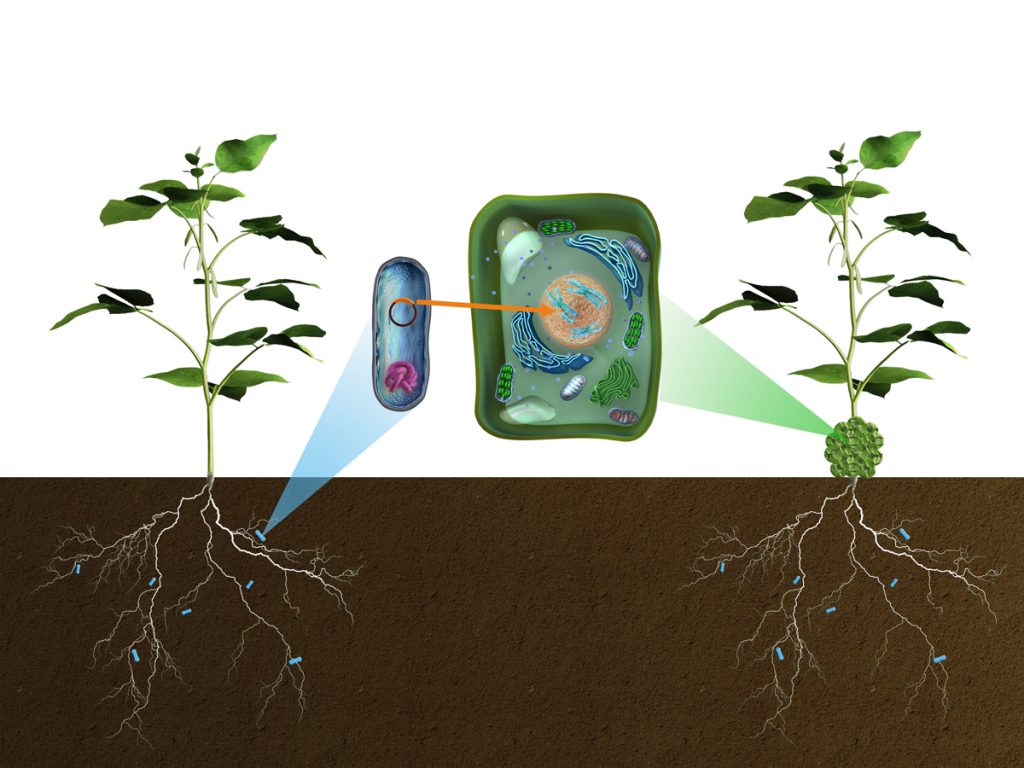
Jordbakterien Agrobacterium tumefaciens kan föra över delar av sitt DNA till växter. Bakterien infekterar en skadad växt i övergången mellan rot och skott och orsakar krongallsjuka. Vid platsen för infektion blir det en tumörliknande utväxt som beror på att bakterien fört över gener till växten som påverkar nivåerna av tillväxtreglerande ämnen. De får växtcellerna att dela sig okontrollerat. Dessutom för bakterien över gener som får tumörcellerna att producera ämnen, opiner, som den livnär sig på.
Agrobacterium orsakar alltså horisontell genöverföring – den för över gener från en organism till en annan – och är en naturligt förekommande genmodifierare. I och med att vi nu har tillgång till den fullständiga DNA-sekvensen för många olika växters genom kan man se att den här bakterien har varit flitig med att flytta in sina gener i olika växtarter (läs vidare under ”Genetisk modifiering i naturen”).
Hur kan en bakterie flytta in sina gener i en växts genom?
Ett stort steg i växtforskningen och för möjligheten att förädla grödor med genteknik togs i början av 1980-talet. Då började man förstå i detalj hur Agrobacterium gör när den för över sitt DNA till växtens genom.
Bakterier har DNA packat i kromosomer och i ringformade strukturer som kallas plasmider. I plasmiderna finns gener som gynnar bakterierna i en viss miljö. Forskare fann att Agrobacterium har en ovanligt stor plasmid som bär på de gener som ska integreras i växtcellens DNA. Dessa gener sitter i en del av plasmiden som kallas för transferDNA, eller T-DNA. Plasmiden har också gener för att producera virulensfaktorer, som är de proteiner som guidar in bakerie-DNAt i växtens celler.
När skadade växtceller skickar ut kemiska signaler aktiveras Agrobacteriums virulensfaktorer. De känner av de specifika sekvenser som omger T-DNA, klipper ut T-DNAt från plasmiden och guidar det från bakterien och in i växtcellen. Inne i växtcellen för sedan virulensfaktorer T-DNAt vidare in i cellkärnan där det integreras på slumpvis ställe i växtens genom. Här uttrycks sedan bakteriens gener och ger då upphov till en tumör.
Bakterie i genteknikens tjänst
Agrobacteriums naturliga förmåga att föra över och integrera DNA i växters genom kan användas för växtforskning och växtförädling. Det är möjligt eftersom bakterien inte känner någon skillnad på vilka gener som finns som T-DNA. Den för alltså lika gärna över den eller de gener forskaren väljer, som sina egna.
Med hjälp av genteknik har man ändrat Agrobacteriums stora plasmid för att göra den enklare att arbeta med i labbet. Man har till exempel delat upp den på två mindre plasmider i stället, en med virulensfaktorgenerna och en mindre plasmid som bär på T-DNAt. I T-DNA-plasmiden har man tagit bort bakteriens tumörframkallande gener och i stället satt in en så kallad markörgen. En markörgen gör det möjligt att se vilka växter eller växtceller som blivit genetiskt modifierade. Det kan till exempel vara en gen som ger motståndskraft mot ett ogräsmedel.
Det finns numera olika T-DNA-plasmider som är skräddarsydda för olika ändamål, och ofta har de också speciella sekvenser som underlättar för forskaren att sätta in en ny gen i plasmidens T-DNA-region, bredvid markörgenen. Den här typen av manipulationer gör forskaren i ett provrör. När det är klart för man tillbaka plasmiden till Agrobacterium och låter bakterien infektera växten.
Vissa växter modifieras enkelt av Agrobacterium
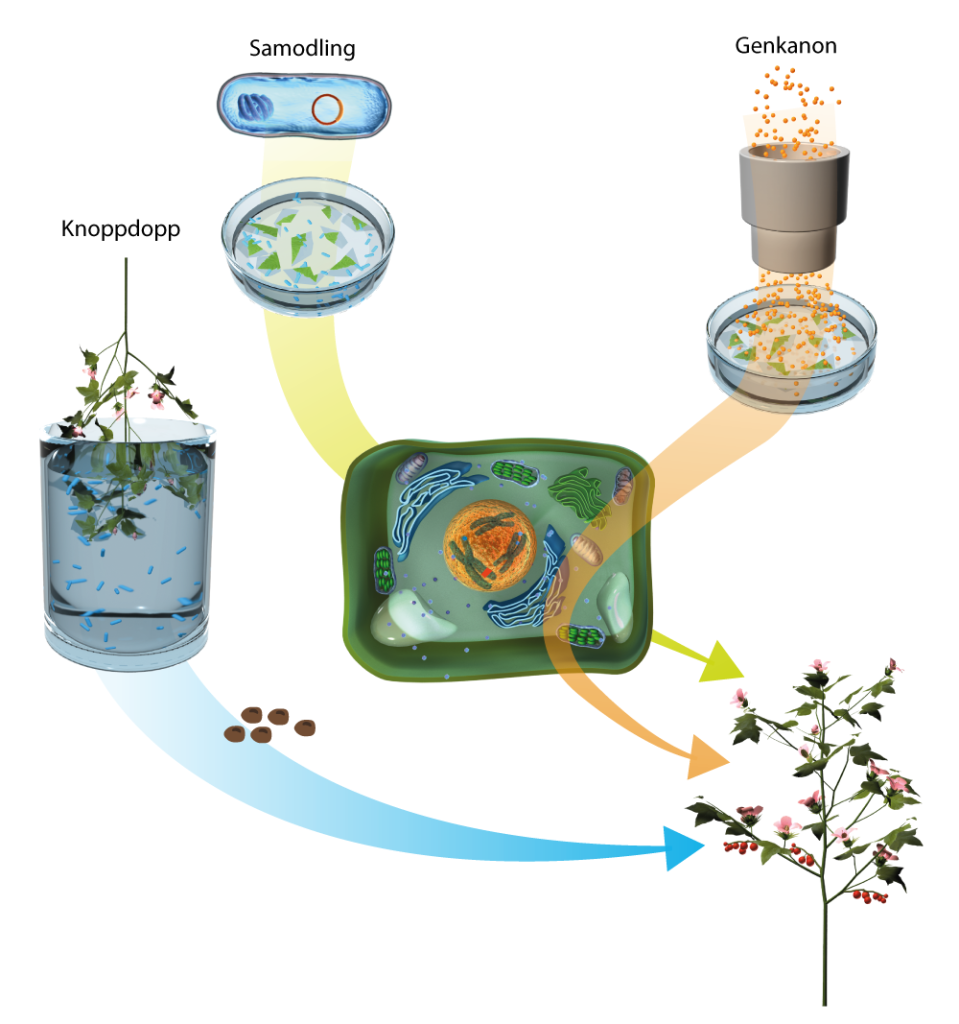
Agrobacterium infekterar en hel del olika växterarter, till exempel forskarnas favoritmodellväxt, backtrav, Arabidopsis thaliana. För att backtrav ska infekteras och därmed bilda genmodifierade frön räcker det att doppa växten när den är i knopp och precis ska börja blomma i en Agrobacterium-soppa. De flesta andra arter är betydligt mindre mottagliga och enhjärtbladiga växter, som ris, majs och vete, är relativt motståndskraftiga mot Agrobacterium-infektion.
För att kunna infektera mer motståndskraftiga växter, eller för att infektera växtceller utan att växten behöver gå i blom och bilda frön, så kan man använda cell-och vävnadsodling. Då låter man Agrobacterium infektera exponerade celler av bladbitar eller tunna stammar, som behandlats så de är sterila, och odlas i burkar på näringsmedium. Man kan också infektera enskilda växtceller som fått sin cellvägg upplöst, så de bara omges av sitt plasmamembran på samma sätt som djurceller. Sådana växtceller kallas för protoplaster. En lösning med Agrobacterium kan tillsättas till vävnadsbitarna eller protoplasterna, och bakterien kommer då infektera de celler den kommer i kontakt med när de samodlas.
De infekterade och modifierade cellerna flyttas sedan till nytt näringsmedium med hormoner som stimulerar celldelning och rot- och skottbildning. I det här steget vill man också skilja ut de celler som modifierats från sådana som inte gjort det. Beroende av vilken markörgen man använt kan man till exempel tillsätta det ogräsmedel som modifierade celler ska vara okänsliga mot. Då dör alla celler som inte tål medlet, och bara de modifierade fortsätter dela sig. När sedan rötter och skott bildats kan de modifierade växterna flyttas över på jord och odlas vidare.
Genkanoner skjuter in DNA i växtcellen
DNA kan också föras in i växtens celler utan att ta hjälp av en bakterie. I stället kan man använda en så kallad genkanon för att skjuta in mycket små guldpartiklar täckta med DNA i växtceller. Väl inne i cellerna kan DNAt sedan integrera i växtens genom. Det här kan fungera också på växter som Agrobacterium har svårt att infektera. Det är också ett sätt att föra in större DNA-bitar med flera gener, än vad Agrobacterium klarar av. Det är också en metod för att föra in DNA i den del av växtens genom som finns i kloroplaster eller mitokondrier. Ett problem med metoden är dock att det ofta integreras många kopior och att det DNA som förs in också kan bli omstrukturerat på ett sätt som är svårt att förutsäga.
Andra sätt att genetiskt modifiera växter är att utsätta protoplaster för en elektrisk puls eller behandla dem med ett medel, som gör att DNA tas upp över plasmamembranet. Man har också använt sig av mikroinjektion för att direkt föra in DNAt i cellen.
Verktyg för genomredigering direkt kan föras in i växtcellen
Protoplaster kan alltså relativt enkelt fås att släppa in DNA. Även proteiner och RNA-molekyler kan tas upp. Det här är viktigt när man vill använda genomredigeringsverktyg, som gensaxen CRISPR/Cas9. Med en gensax kan man förändra växtens genom utan att föra in något främmande DNA. I korthet så går metoden ut på att ett guide-RNA bestämmer vart CAS9-enzymet ska klippa upp växtgenomets DNA-sträng. Växtcellen ser sedan till att laga ett sådant DNA-strängsbrott. Eftersom lagningen ofta är ganska oprecis så ger det upphov till en ändring i DNA-sekvensen. (Läs mer under ”Genomredigering med gensaxar”.)
Ofta för man in CRISPR/CAS9-generna med hjälp av Agrobacterium, och då kommer de generna att integreras i växtens genom. För att bara behålla genomredigeringen men undvika främmande gener i genomet måste man sedan korsa bort CRISPR-generna, för att segregera bort dessa. Det gör man genom att korsa den genomredigerade växten med den icke-modifierade varianten. Efter ett par generationer analyserar man sedan avkommorna, och behåller de växter som bara har genomredigeringen, men inte CRISPR-generna. Det här kräver förstås att man kan få växten att gå i blom och sätta frö. Om man till exempel vill modifiera potatis eller banan kan detta vara mycket besvärligt.
Man kan då istället direkt föra in guideRNAt och CAS9-enzymet direkt i protoplaster, och därmed undvika att någon gen behöver integreras i genomet. De här molekylerna kommer så småningom brytas ner, och enbart det jobb de utfört, genomredigeringen, blir kvar.

