I tabellen nedan listas de sjukdomar för vilka genterapier kan behandlas inom EU och om de de används i Sverige vilket baseras på rekommendation från Rådet för nya terapier (NT-rådet).
Genterapier som godkänts inom EU och NT-rådets rekommendation
| Sjukdom | Produkt | År för godkännande | NT-rådets rekommendation |
| Hyperlipoproteinemi typ 1 | Glybera* | 2012 | Ingen, tillstånd återkallat. |
| Metastaserat melanom | Imlygic | 2015 | Ej utvärderad |
| Svår kombinerad immunbrist (SCID-ADA) | Strimvelis | 2016 | Under utredning |
| Akut lymfatisk leukemi (blodcancer) och storcelligt B‑cellslymfom (cancer i lymfsystemet) | Kymriah (CART) | 2018 | Använd för akut lymfatisk leukemi hos barn och unga |
| Hereditär retinal dystrofi (ärftlig blindhet) | Luxturna | 2018 | Bör användas. |
| Diffust storcelligt B-cellslymfom (cancer i lymfsystemet) | Yescarta (CART) | 2018 | Kan användas. |
| Beta-thalassemia (hemoglobinsjukdom) | Zynteglo* | 2019 | Ingen, tillstånd återkallat. |
| Spinal muskelatrofi | Zolgensma | 2020 | Bör användas för små barn med typ 1 SMA och viss genetik |
| Metakromatisk leukodystrofi (ämnesomsättningssjukdom) | Libmeldy | 2020 | Bör användas. |
| Mantelcelllymfom (cancer i lymfsystemet) | Tecartus (CART) | 2020 | Kan användas. |
| Multipelt myelom (cancer i benmärgen) | Abecma (CART) | 2021 | Avvakta utredning. |
| Cerebral adrenoleukodystrofi (hjärnsjukdom) | Skysona* | 2021 | Ingen, tillstånd återkallat. |
| Hodkins lymfom (cancer i lymfsystemet) | Breyanzi (CART) | 2022 | Kan användas. |
| Hemofili A (blödarsjuka) | Roctavian | 2022 | Avvakta utredning. |
| Multipelt myelom (cancer i benmärgen) | Carvykti (CART) | 2022 | Kan användas. |
| AADC-brist (neurologisk sjukdom) | Upstaza | 2022 | Avvakta utredning. |
| Hemofili B (blödarsjuka) | Hemgenix | 2023 | Använd inte. |
| Sicklecellanemi och beta-thalassemi(hemoglobinsjukdom) | Casgevy ** | 2024 | Avvakta utredning. |
| Hemofili B (blödarsjuka) | Durveqtix | 2024 | Ingen, avvecklas av företaget |
| Dystrofisk epidermiolysis bullosa (hudsjukdom) | Vyjuvek | 2025 | Avvakta utredning. |
** genomredigerande behandling med CRISPR/Cas9
CART = CAR-T-cellterapi
En genterapi klassas som ett GMO-läkemedel eftersom DNA i celler blir modifierade. Mer information om hur den här typen av läkemedel definieras och regleras finns på sidan om GMO-läkemedel. De virusvektorer som oftast används för att transportera in nytt DNA (eller CRISPR/Cas9) i en cell är också genetiskt modifierat och därmed en GMO enligt EU:s lagstiftning. Vid kliniska prövningar utvärderas därför en genterapis risk för miljön.
Hälsoekonomisk utvärdering av genterapier
När en genterapi godkänts inom EU så görs i regel en bedömning i Sverige ifall regionerna bör använda den nya behandlingen eller inte. Rekommendationerna lämnas av Rådet för nya terapier (NT-rådet) i nära samarbete med Tandvårds- och Läkemedelsförmånsverket.
NT-rådet består av experter från Sveriges alla regioner. Rådet ska säkerställa en rättvis, jämlik och ändamålsenlig användning av läkemedel så att gemensamma resurser nyttjas på bästa sätt. Bedömningen baseras på den etiska plattformen (principer som beslutats av Sveriges riksdag) och en hälsoekonomisk värdering av läkemedlet. I en hälsoekonomisk värdering vägs kostnaden för läkemedlet mot samhällets vilja att betala för det.
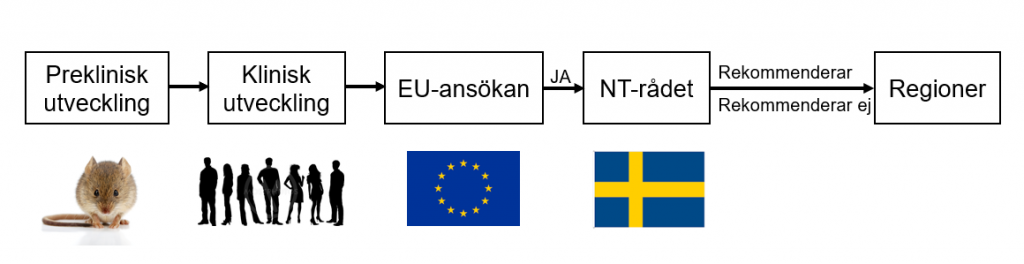
En genterapis väg från forskningslaboratoriet till patienter på svenska sjukhus.
Själva idén med en genterapi är att den ska ges vid ett enda behandlingstillfälle. När cellerna som modifierats (med en ny gen eller redigerats med CRISPR/Cas9) delar sig följer effekten med. Det beror på att allt DNA i en cell kopieras inför varje celldelning.
Eftersom genterapier är en relativt ny företeelse är det svårt att veta om det är en engångsbehandling. Hur länge sitter behandlingseffekten i? Det är därför särskilt svårt att väga nyttan mot kostnaden.
Många genterapier är också utvecklade för ovanliga sjukdomar där patienterna är få och möjligheten att utföra större kliniska studier små. Det gör att underlaget som ska bedömas vid en hälsoekonomisk utvärdering inte är lite robust som för ett annat läkemedel.
Genterapier är dyra!
Den allra största utmaningen för regionerna är att genterapier är oerhört dyra. En dos med Zolgesma eller Zynteglo, som båda baseras på genetiskt modifierade celler, kostar mellan 17–20 miljoner kronor. Det är en betydande summa i regionernas årsbudget.
Genterapier som baseras på oligonukleotider är mindre kostsamma per dos, med de ges å andra sidan vid flera tillfällen. Spinraza beräknas till exempel kosta 4,8 miljoner under första behandlingsåret och sedan 2,4 miljoner årligen under resten av patientens liv.
De CAR-T-cellterapier som rekommenderas av NT-rådet är lite billigare och kostar mellan 3,2 och 3,5 miljoner kronor per dos.
Det förs diskussioner om alternativa sätt att betala för genterapier, till exempel med avbetalningsplaner, flexibla budgetar, en särskild pott för genterapier eller så kallad riskdelningsbetalning. Det seanre innebär att hela eller delar av betalningen görs först när läkemedlet visat sig fungera. Den senare modellen används i olika form av Storbritannien, Tyskland, Spanien, Italien och Frankrike för Yescarta och Kymirah.
De genterapier som rekommenderas av NT-rådet har sannolikt förhandlats ner i pris, till en summa som företagen brukar vilja hemlighålla. Region Stockholm har en webbsida där det går att söka på genterapins namn och läsa de rekommendationer som är klara.
Uppdaterad sida 2024-03-25

