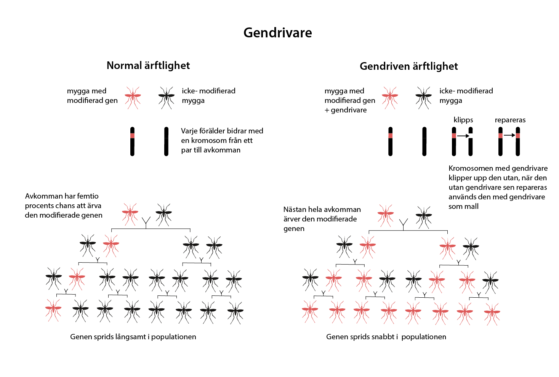
Med en gendrivare i arvsmassan kan en specifik gen eller mutation snabbt sprida sig i en population av växter eller djur. Därmed sprids också en egenskap. Utan en gendrivare är det 50 procents chans att en viss gen ärvs av en avkomma. Det gör att genen sprider sig långsamt i en population. Med en gendrivare sprider den sig snabbt. Den ser nämligen till att genen eller mutationen förekommer i homozygot form i varje generation, det vill säga att genen/mutationen finns på båda kromosomerna i ett kromosompar.
Vissa delar av DNA:t ärvs av avkomman oftare än normalt. De följer inte Mendels lagar. De kopierar sig själva till andra delar av arvsmassan och kallas ibland själviska gener. Forskare har inspirerats av detta och idén om att med hjälp av själviska gener som gendrivare kontrollera sjukdomsbärande insekter föreslogs redan 2003. Det var dock först i och med att gensaxen CRISPR/Cas9 utvecklades som forskningen tog fart. Det visade sig nämligen att CRISPR/Cas9-systemet är som klippt och skuret att fungera som gendrivare.
I mars 2015 publicerades en vetenskaplig artikel där forskare för första gången visade att gendrivare fungerade i praktiken. Bananflugor modifierades med CRISPR/Cas9 som skapade en specifik mutation i bananflugornas arvsmassa, en mutation som spreds sig i flugpopulationen. Innan årets slut hade forskare testat gendrivare på malariamyggorna Anopheles stephensi respektive Anopheles gambiae, den huvudsakliga malariamyggan på den afrikanska kontinenten. De sistnämnda forskarna använde gendrivare för att sprida sterilitet bland mygghonorna. Det fungerade till en början väl, men efter ett antal generationer började det skapas naturliga mutationer som reducerade gendrivarens effektivitet. Myggorna hade blivit resistenta mot gendrivaren.
Forskarna började då närmare undersöka mutationer i gener kopplade till honornas fertilitet och förfinade systemet. I en artikel publicerad i september i år kunde de visa att de två myggpopulationer som studerades kollapsade efter sju respektive elva generation. Detta utan några problem med resistensutveckling, det vill säga reducerad effektivitet till följd av naturliga mutationer. Forskarna menar dock att de inte kan säga att det med deras system aldrig kommer att utvecklas resistens.
Enligt Världshälsoorganisationens World Malaria Report 2017, rapporterades 216 miljoner fall av malaria under 2016, en ökning med fem miljoner jämfört med föregående år. Antalet dödsfall till följd av malaria var år 2016 445 000 vilket är ungefär samma antal som 2015.
I juni i år bad EU-kommissionen den europeiska myndigheten för livsmedelssäkerhet (EFSA) att lämna ett yttrande om gendrivare. I EFSA:s mandat ingår bland annat att identifiera potentiella risker när det gäller påverkan på människor och djurs hälsa och på miljön. Vidare ska EFSA fastställa om nuvarande vägledningsdokument för riskbedömning av genetiskt modifierade organismer är adekvata och tillräckliga för riskbedömning av gendrivare eller om de behöver utvecklas.
Källor
A CRISPR-Ca9 gene drive targeting doublesex causes complete population suppression in caged Anopheles gambiae mosquitoes. Kyrou et al, Nature Biotechnology published online 24 september 2018; doi:10.1038/nbt.4245
The mutagenic chain reaction: A method for converting heterozygous to homozygous mutations. Gantz & Bier, Science 348(6233):442-444 (2015)
Biologists devise invasion plan for mutations. J. Bohannan, Science 347(6228):1300 (2015)
Highly efficient Cas9-mediated gene drive for population modification of the malaria vector mosquito Anopheles stephensi. Gantz et al, Proc Natl Acad Sci. 112(49), 2015
A CRISPR-Cas9 gene drive system targeting female reproduction in the malaria mosquito vector Anopheles gambiae. Hammond et al, Nature Biotechnology, 2016; 34:78-83.
Director General for Food Safety, Ref. Ares(2018)2953435 – 06/06/2018

