Att utveckla säkra och effektiva genterapier och få dem godkända för klinisk användning tar lång tid. Inom EU har 17 genterapier ur den första kategorin godkänts och en ur den andra.
Forskare har främst fokuserat på att utveckla genterapier för monogena sjukdomar som orsakas av mutationer i en enda gen och för olika typer av blodcancer. De genterapier som utvecklas för att behandla cancer är främst så kallade CAR-T-cellterapier – som både är en form av genterapi och immunterapi.
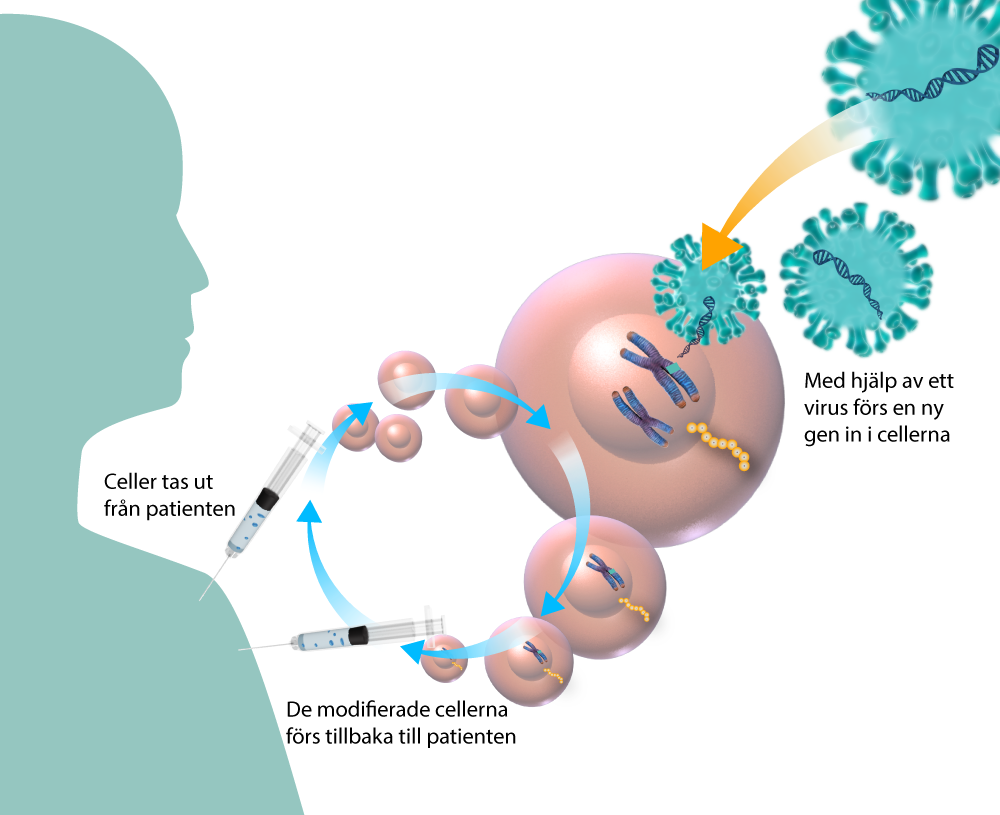
En ny gen förs in i patientens celler
Vid den hittills vanligaste formen av genterapi förs en ny terapeutisk gen in i ett urval av patientens celler (målceller). Inne i cellen kompenserar den nya genen för en muterad gen som orsakar sjukdom.
Den nya genen förs ofta in ex vivo, det vill säga ”utanför kroppen”. Det innebär att målcellerna isoleras från patienten och den terapeutiska genen förs in i cellerna när de till exempel är i en petriskål i ett laboratorium. Sedan försökas cellerna upp och återförs till patienten som behandling. Beroende på vilken sjukdom som ska behandlas är målcellerna olika men oftast kan de utvinnas ur ett blod eller benmärgsprov.
Det finns också genterapier där celler modifieras med en ny gen in vivo, det vill säga när cellerna är kvar i patientens kropp. Det används när målcellerna inte kan isoleras, till exempel synceller i ögat.
Den här formen av genterapi kan liknas vid en transplantation där en ny gen förs in i kroppen istället för ett nytt organ. Effekten blir bestående eftersom allt DNA kopieras inför celldelning.
Ett exempel på en genterapi som utförs ex vivo:
Strimvelis är en genterapi som utvecklats för en form av svår kombinerad immunbrist som heter SCID (eng. Severe Combined Immune Deficiency). Sjukdomen orsakas av en mutation i genen ADA och benämns därför ofta SCID-ADA. Mutationen leder till att det bildas för lite av ett enzym som behövs för att bygga upp ett normalt immunförsvar.
Vid den genterapi som utvecklats för att behandla SCID-ADA isoleras stamceller från patienten och en ny ADA-gen förs in. När cellerna återförs gör den nya genen att enzymet börjar tillverkas och patienterna bygger upp ett normalt immunförsvar. Strimvelis ges i dagsläget inte i Sverige.
Ett exempel på en genterapi som utförs in vivo:
Luxturna är en behandling för retinal dystrofi som är en form av ärftlig blindhet. Sjukdomen beror på en mutation i genen PRE65 som leder till en brist på ett enzym som krävs för att fotoreceptorcellerna (tapparna och stavarna) ska fungera.
Genterapin ges som en injektion i ögats näthinna (retina) där det levererar en ny RPE65-gen som översätts till ett funktionellt enzym. Effekten av genterapin har varit olika men de flesta får en förbättrad ledsyn efter behandlingen. Luxturna används i Sverige.
Avväpnade virus för in den nya genen i cellen
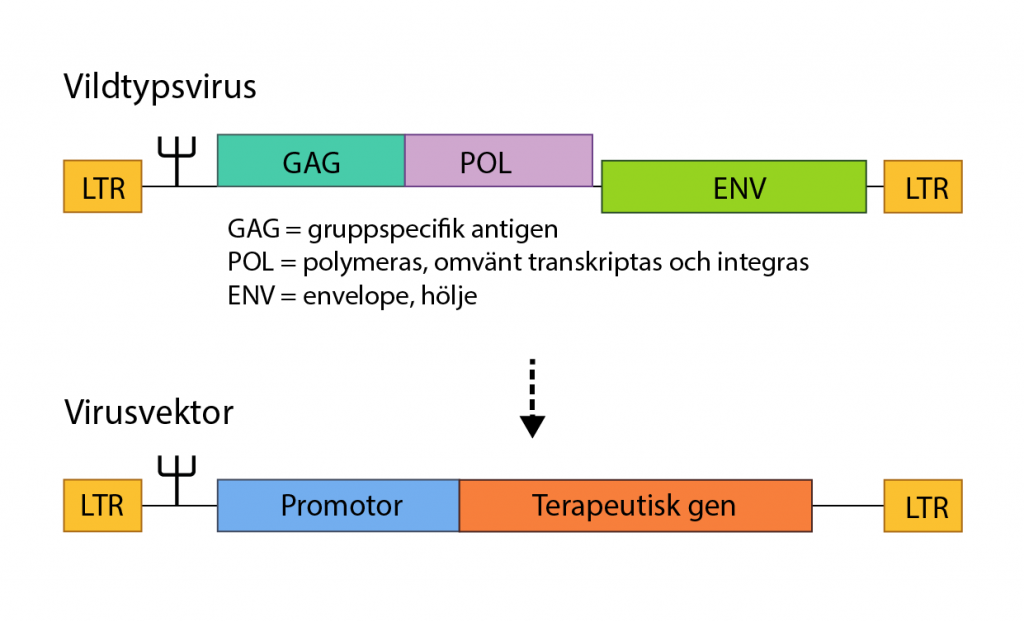
För att den nya genen ska komma på plats inne i cellen används virus som transportörer. De kallas virusvektorer och har modifierats genetiskt så att de inte kan spridas eller orsaka sjukdom.
Redan på 60-talet upptäckte forskare att virus, som är mycket mindre än en mänsklig cell, kan ta sig in hela vägen till cellkärnan hos en värdorganism och lämna av sitt eget genetiska material. Det är ett sätt för viruset att kapa värdens proteintillverkning så att det producerar de proteiner som viruset behöver för att dela sig och spridas. Virus har själva ingen proteintillverkning.
Vissa virus fogar in sitt genetiska material (DNA eller RNA) i värdorganismens DNA och andra lämnar det löst bredvid. I båda fall kommer det att transkriberas till ett mRNA och föras ut till ribosomerna utanför cellkärnan som tillverkar proteiner.
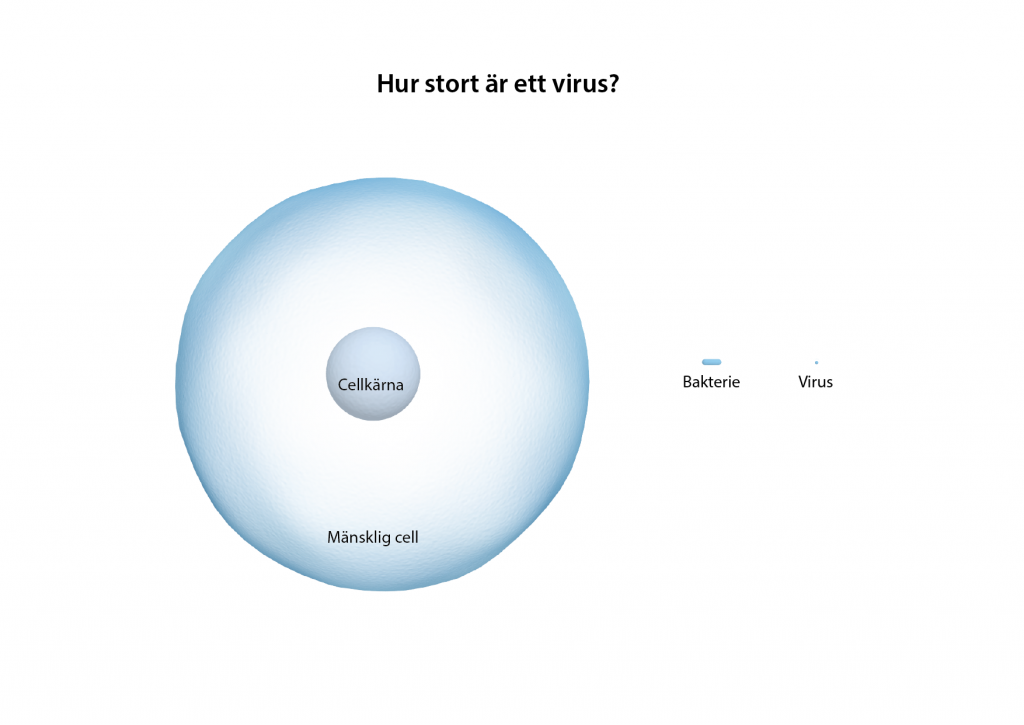
Forskare förstod snabbt att det går att använda virus för att transportera annat genetiskt material än virusets egna, till exempel en terapeutisk gen. I det sammanhanget används viruset som som en vektor och när en gen förs in i en cell med hjälp av en virusvektor kallas det för transduktion.
De gener som krävs för att viruset ska spridas har tagits bort och ersatts med den terapeutiska genen. De vanligaste vektorerna är genetiskt modifierade retrovirus och adenovirus.
CAR-T-celler, både en immunterapi och en genterapi
Till genterapier räknas också en typ av cancerbehandlingar som heter CAR-T-cellterapier. De är också som en form av immunterapi eftersom patientens eget immunförsvar riktas mot sjukdomen.
Vid en CAR-T-cellterapi förs en ny gen in i en typ av immunceller som heter T-celler. Oftast isoleras T-cellerna från patienten, men de kan också vara en donators.
Den nya genen kodar för en chimär antigen receptor och som förkortas CAR. Med CAR blir T-cellerna bättre på att upptäcka cancerceller via ett specifikt protein som finns på cancercellers utsida.
Inom EU finns ett antal godkända CAR-T-cellterapier och några används redan på cancerpatienter i Sverige. Mer information om vilka terapier som är godkända finns på sidan Godkända genterapier.
I några mindre studier har forskare även kunnat visa att CAR-T-cellterapier ger god behandlingseffekt för autoimmuna sjukdomar. Det går att läsa mer om i forskningsnyheterna:
Patienter med SLE hjälpta av CAR-T-cellterapi.
Positiv effekt av CAR-T-celler för patienter med den autoimmuna sjukdomen myesthenia gravis.
En CRISPR-baserad genterapi är godkänd
Med gensaxar som CRISPR/Cas9 är det möjligt att med hög precision ändra (redigera) befintligt DNA, till exempel en mutation i en gen som orsakar sjukdom. Det går att använda teknikerna på många sätt – enklast är att stänga av gener. När CRISPR/Cas9 används kallas det för genomredigering (ibland även genredigering).
Det finns en godkänd genterapin som baseras på CRISPR/Cas9-teknik och ett hundratal prövas kliniskt. Det innebär att de prövas på patienter men är ännu inte godkända. De genterapier som prövas har utvecklats för att behandla en rad olika sjukdomar till exempel hemoglobinsjukdomar, ärftlig blindhet, HIV och olika typer av cancer.
Ett exempel på en genterapi där CRISPR/Cas9 används
Casgevy är utvecklad för behandling av hemoglobinsjukdomarna sicklecellanemi och beta thalassemi. Båda sjukdomarna orsakas av mutationer i HBB som är en av de gener som kodar för hemoglobin. Hos patienter med sjukdomarna tillverkas inte funktionellt hemoglobin vilket gör att blodet inte på ett effektivt sätt kan transportera syre i kroppen. Patienter får symtom som till exempel blodproppar, blodbrist och svår smärta till följd av syrebrist i vävnader och organ.
Det finns en annan form av hemoglobin som kan kompensera för bristen av funktionellt hemoglobin. Det bildas under fosterstadiet och kallas fetalt hemoglobin. En transkriptionsfaktor som heter BCL11A som stänger av tillverkningen av fetalt hemoglobin efter födseln. Strategin bakom genterapin är att med CRISPR/Cas9 stänga av den gen som kodar för transkriptionsfaktorn i blodbildande stamceller. Då återupptas tillverkningen av fetalt hemoglobin.
Behandlingen har gett mycket positiv effekt och nästan alla patienter som mottagit den är inte längre i behov av annan behandling. De är också i stort sett symtomfria. Det var med den här genterapin som forskare för första gången visade att en CRISPR/Cas9-baserad genterapi fungerade och det var också den första som godkändes för användning.
Genterapi utförs inte i könsceller och modifieringen blir därför inte ärftlig
När man talar om genterapi är det viktigt att skilja på vilka slags celler som används, eftersom det avgör om den genetiska modifieringen blir ärftlig eller inte. Den form av genterapi som används utförs i kroppsceller och inte könsceller. Den är därför inte ärftlig utan påverkar bara patienten som mottar behandlingen. Det kallas för somatisk genterapi (somatiska celler = kroppsceller).
När könsceller (ägg, spermier) eller befruktade ägg modifieras kan modifieringen nedärvas till nästa generation. Det är inte lagligt att utföra den typen av förändringar på människor, bland annat enligt lagen om genetisk integritet.
Det är dock tillåtet för forskare med särskilda etiska tillstånd att forska på ägg som befruktats in vitro upp till 14 dagar efter befruktningen. Det är viktigt att påpeka att de modifierade äggen absolut inte får föras in i en kvinnas livmoder där de kan leda till en graviditet.
Oligonukleotider som tystar gener
En annan form av behandlingar baseras på så kallade oligonukleotider. Oftast räknas inte dessa behandlingar som genterapier eftersom de inte resulterar i några förändringar på DNA-nivå.
Oligonukleotider är korta RNA-sekvenser som kan påverka uttrycket (aktiviteten) av gener. Det här kan till exempel användas för att ”tysta” en gen som orsakar sjukdom.
I ett första steg när en gen översätts till ett protein så bildas en kopia av genen i form av ett budbärar-RNA (mRNA). Det sker inne i cellkärnan där nästan allt vårt DNA ligger förvarat i kromosomer. De instruktioner som finns i genen transporteras ut ur cellkärnan med kopian (mRNA) till cellens proteinfabriker, ribosomerna.
Antisens och siRNA
En typ av oligonukleotid som används för att behandla vissa sjukdomar är ett så kallat antisens. Ett antisens-RNA kan konstrueras för att binda komplementärt till ett visst mRNA. När ett antisens binder till ”sitt” mRNA så inaktiveras det och tar sig aldrig till proteinfabriken.
En annan typ av oligonukleotid som används vid behandling av vissa sjukdomar är interfererande RNA (på eng. small interfering RNA, siRNA) som istället bryter ner ett specifikt mRNA innan det hinner översätts till ett protein. När ett mRNA inte översätts till ett protein så kan man säga har genen dämpats, eller helt stängts av.
Exempel på behandlingar med oligonukleotider
För en sjukdom som heter ärftlig transtyretinamyloidos som även kallas Skelleftesjukan, finns två tillgängliga läkemedel som bygger på oligonukleotider. Sjukdomen orsakas av en mutation som gör att proteinet transtyretin byggs upp felaktigt och klumpar ihop sig och lagras i olika vävnader. Inlagringen skadar bland annat nerver, hjärtat, ögonen och njurarna. På sikt leder sjukdomen till en progressiv funktionsnedsättning som kan vara livshotande.
I det ena läkemedlet används siRNA och i den andra ett antisens, men gemensamt för båda är att tillverkningen av transtyretin stängs av. Behandlingarna ges regelbundet med några veckors mellanrum.
En CRISPR/Cas9-baserad behandling för Skelleftesjukan är också under utveckling men är ännu inte godkänd. Mer information om behandlingen finns i forskningsnyheten CRISPR-baserad genterapi mot Skellftesjukan.
Sidan uppdaterades senast 2025-05-09

